目次
パーキンソン病などの神経変性疾患モデルの病態解析とその保護・修復
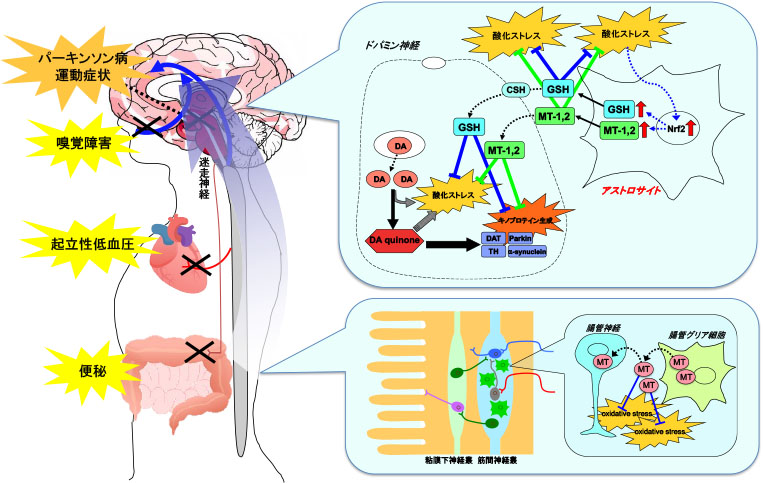
パーキンソン病の病態を「ドパミン神経に特異的な酸化ストレスとしてのキノン体」に焦点をあてて研究し,新たな候補治療薬や細胞移植による治療法を見出してきました.また,新規抗パーキンソン病薬の薬理作用の発現機序の解明に取り組み,「神経・グリア(アストロサイト)連関に基づく抗酸化機構賦活作用」を発見しました.近年,パーキンソン病の疾患概念は大きく変わり,運動症状が発現する5-10年前から既に下位心臓交感神経系,消化管神経系での神経変性が始まっており,早期診断の確立だけでなく神経変性の進行を阻止・遅延させる神経保護療法の開発が求められています.さらに,パーキンソン病のみならずいくつかの神経疾患においてアストロサイトの神経保護機能が認められています.現在,われわれは神経・グリア連関およびアストロサイトの抗酸化防御機構の賦活による神経保護について,特にアストロサイトにおけるグルタチオンやメタロチオネインといった強力な抗酸化防御因子に着目して研究しており,さらに消化管神経系から神経変性の始まるパーキンソン病モデル系を用いて,新しい観点からの神経変性疾患の治療法開発を目指しています.
(1)神経疾患の治療標的としてのアストロサイト
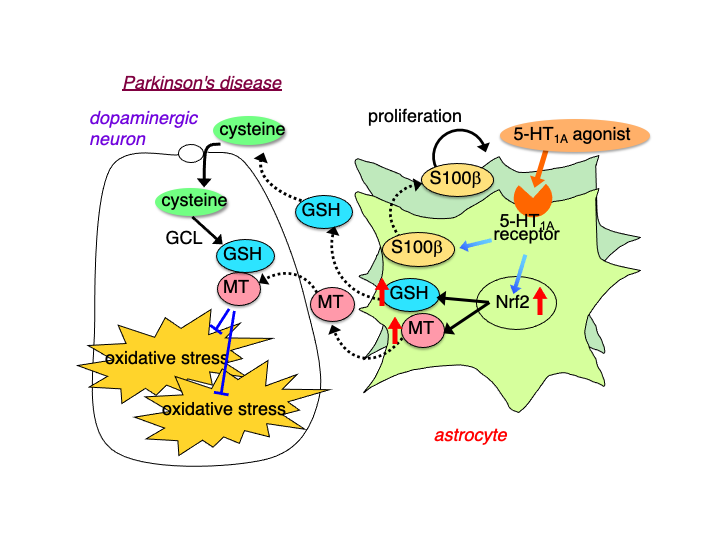
近年,パーキンソン病を含め各種神経疾患におけるアストロサイトの神経保護機能が注目されています.これまでのパーキンソン病におけるアストロサイトの抗酸化防御機構の神経保護作用についての研究,さらにアストロサイトの抗酸化防御機構を高める作用点となり得る分子と薬剤の検索研究の結果として,アストロサイトのセロトニン1A (5-HT1A)受容体を見出しました.5-HT1Aアゴニスト活性を有する中枢神経作用薬のアストロサイトを介した神経保護効果およびメカニズムについて,培養細胞およびパーキンソン病モデル動物を用いて検討しています.これにより,「アストロサイトの5-HT1A受容体を標的とする」という全く新しい観点からの臨床応用可能な新規抗パーキンソン病神経保護薬の開発研究領域の創出を目指します.

Miyazaki et al., Curr. Med. Chem., 23: 686, 2016.
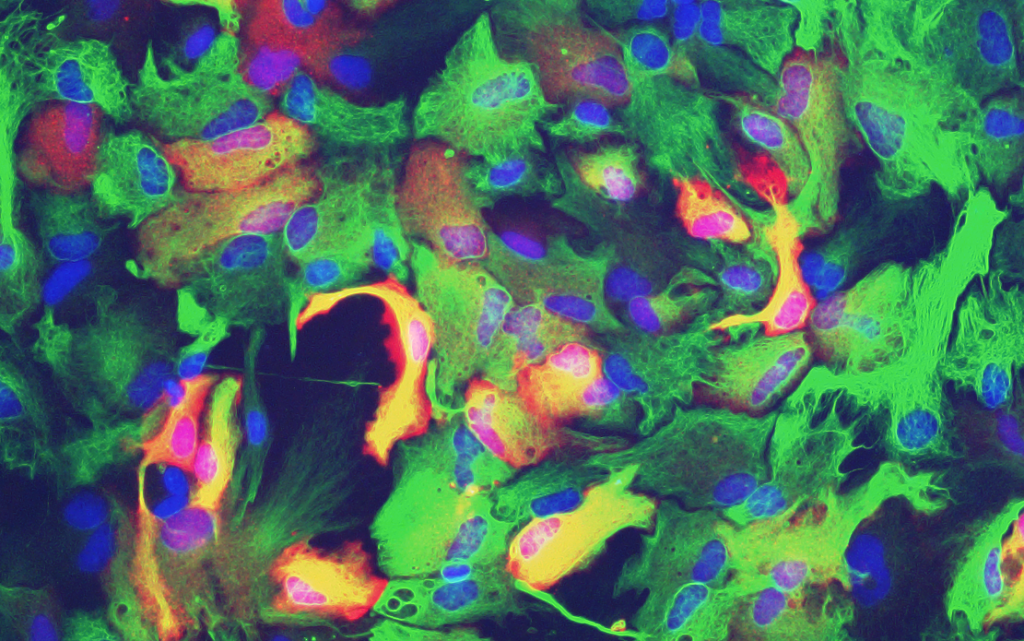
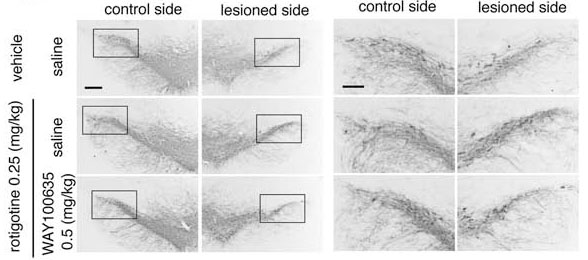
パーキンソン病治療薬ロチゴチンがアストロサイトの5HT1A受容体に作用し,アストロサイトにおけるメタロチオネイン発現を誘導すること,パーキンソン病モデルマウスでの黒質ドパミン神経変性を抑制することを報告しました.
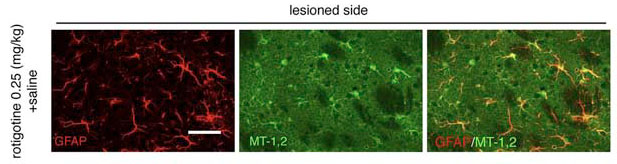
アストロサイトにおけるメタロチオネイン発現誘導
Isooka et al., Neurochem. Int., 132: 104608, 2020.
Isooka et al., Neurochem. Int., 132: 104608, 2020.
抗うつ薬ミルタザピンが神経細胞への作用を介してアストロサイトの5-HT1A受容体に作用し,アストロサイトにおけるメタロチオネイン発現を誘導すること,パーキンソン病モデルマウスでの黒質ドパミン神経変性を抑制することを報告しました.
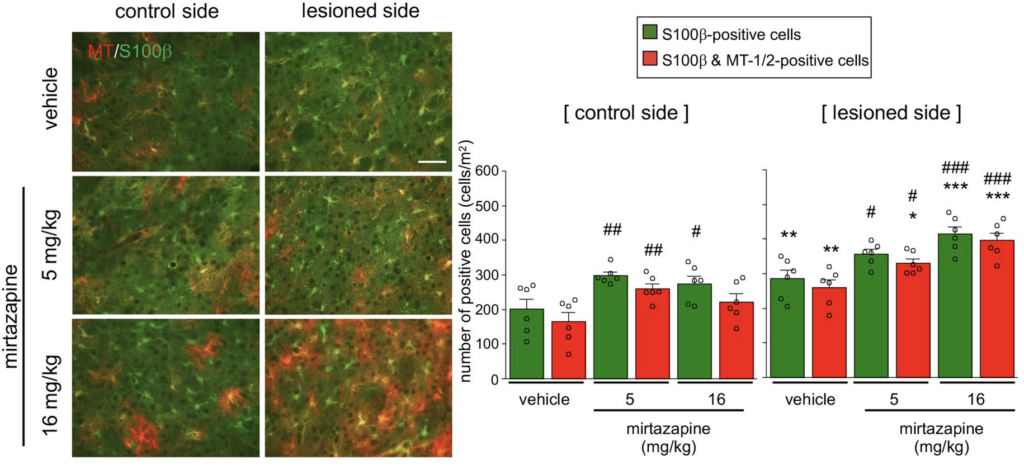
アストロサイトにおけるメタロチオネイン発現誘導
Kikuoka et al., Sci. Rep. 10: 20698, 2020.
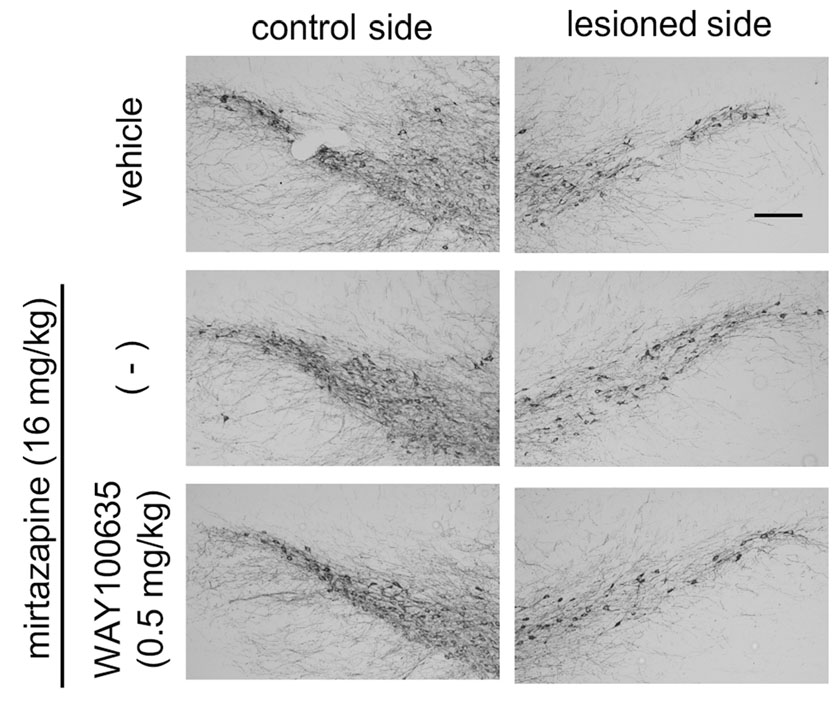
Kikuoka et al., Sci. Rep. 10: 20698, 2020.
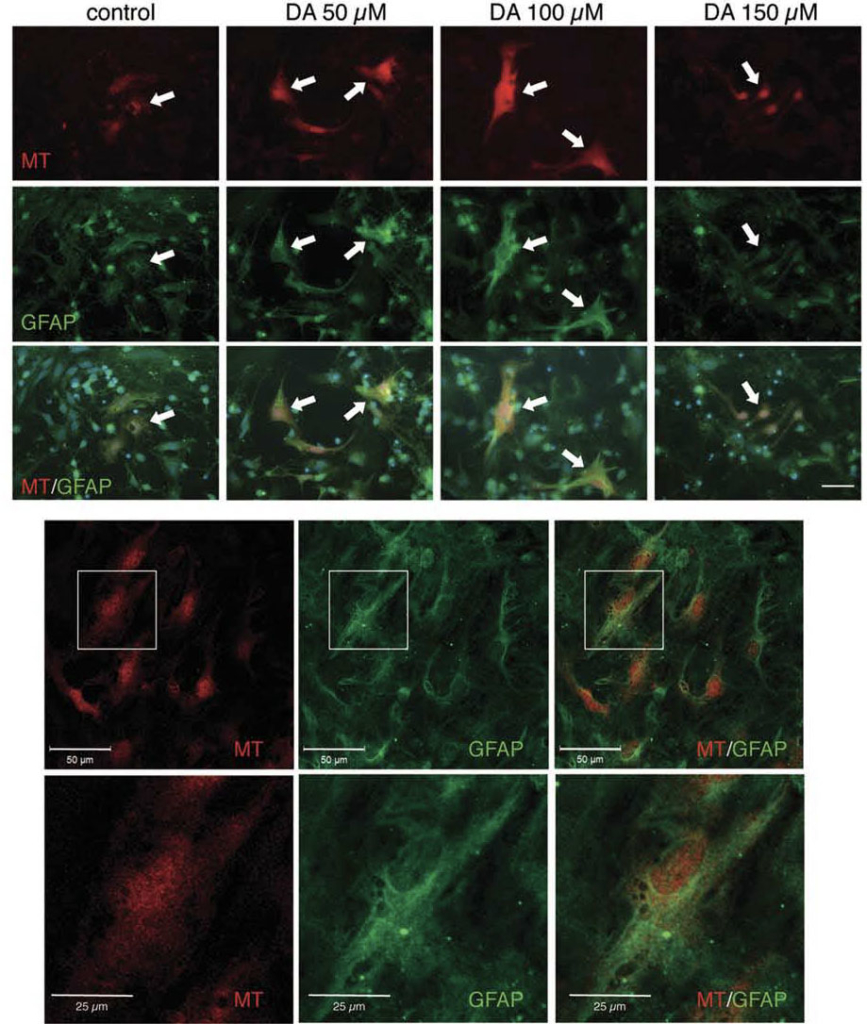
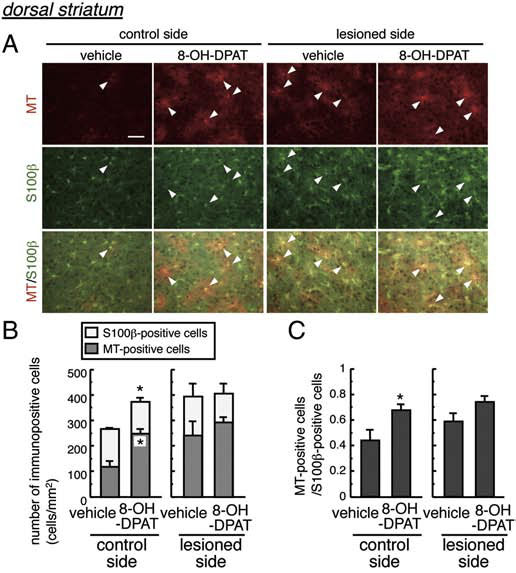
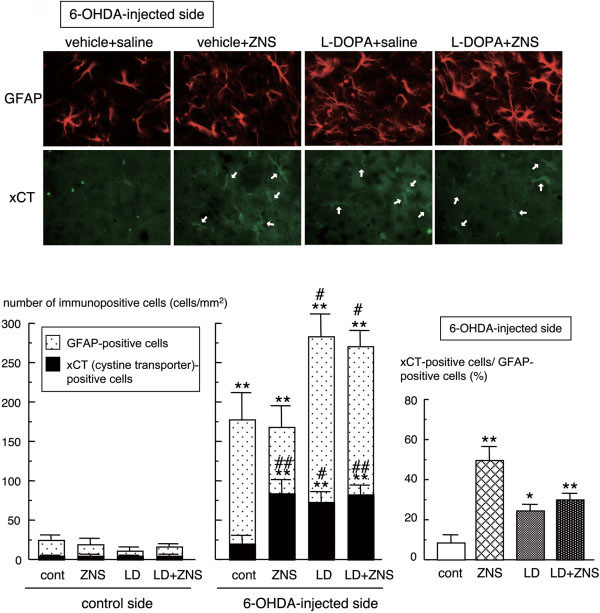
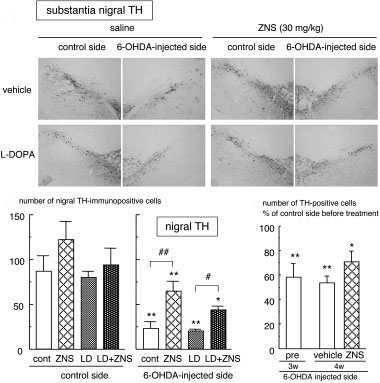
強力な抗酸化分子であるメタロチオネインは,酸化ストレスに反応してアストロサイトにおいて特異的に誘導されることを見出しました.また,5-HT1Aアゴニスト8-OH-DPATがアストロサイトのメタロチオネイン発現を誘導するなど抗酸化機構を賦活化し,ドパミン神経を保護することを報告しました.
ゾニサミドがアストロサイトにおけるシスチントランスポーターxCTの発現を誘導し,グルタチオン合成を高めることでドパミン神経保護作用を示すことを見出しました.アストロサイトの抗酸化機構賦活によるドパミン神経保護という新しい神経保護方策を提唱しました.
参考論文 1. Miyazaki, I. and Asanuma, M.: Neuron-astrocyte interactions in Parkinson’s disease. Cells, 9: 2623, 2020. doi:10.3390/cells9122623 2. Kikuoka, R., Miyazaki, I., Kubota, N., Maeda, M., Kagawa, D., Moriyama, M., Sato, A., Murakami, S., Kitamura, Y., Sendo, T. and Asanuma, M.: Mirtazapine exerts astrocyte-mediated dopaminergic neuroprotection. Sci. Rep., 10: 20698, 2020. https://doi.org/10.1038/s41598-020-77652-4 3. Isooka, N., Miyazaki, I., Kikuoka, R., Wada, K., Nakayama, E., Shin, K., Yamamoto, D., Kitamura, Y. and Asanuma, M.: Dopaminergic neuroprotective effects of rotigotine via 5-HT1A receptors: possibly involvement of metallothionein expression in astrocytes. Neurochem. Int., 132: 104608, 2020. doi: 10.1016/j.neuint.2019.104608 4. Asanuma, M., Okumura-Torigoe, N., Miyazaki, I., Murakami, S., Kitamura, Y. and Sendo, T.: Region-specific neuroprotective features of astrocytes against oxidative stress induced by 6-hydroxydopamine. Int. J. Mol. Sci., 20(3): 598, 2019. doi:10.3390/ijms20030598 5. Miyazaki, I. and Asanuma, M.: Therapeutic strategy of targeting astrocytes for neuroprotection in Parkinson's disease. Curr. Pharm. Des., 23(33): 4936-4947, 2017.doi: 10.2174/1381612823666170710163731 6. Miyazaki, I., Murakami, S., Nakano, T., Torigoe, N., Kikuoka, R., Kitamura, Y., Sendo, T and Asanuma, M.: Serotonin-1A agonist 8-OH-DPAT alleviates motor dysfunction and motor neuron degeneration in a model of amyotrophic lateral sclerosis. Ann. Pharmacol. Pharmaceut., 1(1): 1003, 2016. 7. Asanuma, M. and Miyazaki, I.: 3-O-methyldopa inhibits astrocyte-mediated dopaminergic neuroprotective effects of L-DOPA. BMC Neurosci. 17: 52, 2016. doi: 10.1186/s12868-016-0289-0 8. Miyazaki, I., Murakami, S., Torigoe, N., Kitamura, Y. and Asanuma, M.: Neuroprotective effects of levetiracetam target xCT in astrocytes in parkinsonian mice. J. Neurochem., 136(1): 194-204, 2016. doi: 10.1111/jnc.13405 9. Miyazaki, I. and Asanuma, M.: Serotonin 1A receptors on astrocytes as a potential target for treatment of Parkinson's disease. Curr. Med. Chem., 23: 686-700, 2016. doi: 10.2174/0929867323666160122115057 10. Asanuma, M., Miyazaki, I., Murakami, S., Diaz-Corrales, F.J. and Ogawa, N.: Striatal astrocytes act as a reservoir for L-DOPA. PLoS ONE, 9(9): e106362, 2014. doi:10.1371/journal.pone.0106362 11. Miyazaki, I., Asanuma, M., Murakami, S., Takeshima, M., Torigoe, N., Kitamura, Y. and Miyoshi, K.: Targeting 5-HT1A receptors in astrocytes to protect dopaminergic neurons in parkinsonian models. Neurobiol. Dis., 59: 244-256, 2013. doi: 10.1016/j.nbd.2013.08.003 12. Miyazaki, I., Asanuma, M., Kikkawa, Y., Takeshima, M., Murakami, S., Miyoshi, K., Sogawa, N.* and Kita, T.: Astrocyte-derived metallothionein protects dopaminergic neurons from dopamine quinone toxicity. Glia, 59: 435-451, 2011. doi: 10.1002/glia.21112 13. Asanuma, M., Miyazaki, I., Duaz-Corrales, F.J., Kimoto, N., Kikkawa, Y., Takeshima, M., Miyoshi, K. and Murata, M.: Neuroprotective effects of zoniamide target astrocyte. Ann. Neurol., 67: 239-249, 2010. doi: 10.1002/ana.21885
(2)農薬ロテノン慢性皮下投与パーキンソン病モデルの脳腸病態における神経グリア連関
孤発性パーキンソン病の主病変は選択的な黒質ドパミン神経の消失と考えられてきましたが,Braakの仮説が提唱されて以来,現在では中枢神経系のみならず消化管Auerbach神経叢や心臓の交感神経終末など末梢自律神経系をも侵しうる全身病と考えられています.現在のところ,パーキンソン病における神経障害メカニズムは未だ明らかとなっていませんが,末梢からα-シヌクレインの凝集を伴う神経変性が上行伝播し,中脳黒質に至った段階で発症するというproteinopathy仮説と,部位特異的な脆弱性が変性の差異をもたらすという仮説の二つの仮説が想定されています.私たちは,神経を取り囲むアストロサイト(様細胞)の部位特異的な反応性の差異に着目し,パーキンソン病における特定の神経系にみられる神経障害機構を解明する研究を行っています.
神経-グリア連関が腸管神経系にも存在する
私達は,低用量のロテノンをマウスに全身性に4週間慢性皮下投与することで,中枢・末梢神経障害をきたす新規パーキンソン病モデル動物を確立しました.このロテノン投与マウスは,黒質のドパミン神経細胞,延髄迷走神経背側運動核でのコリン作動性神経細胞,腸管筋間神経叢の変性脱落とα-シヌクレインの発現誘導,さらに運動機能障害,腸管機能障害を示すことから,パーキンソン病の中枢および末梢神経系の病態を再現しうる有用なモデル動物となりうると考えられます.
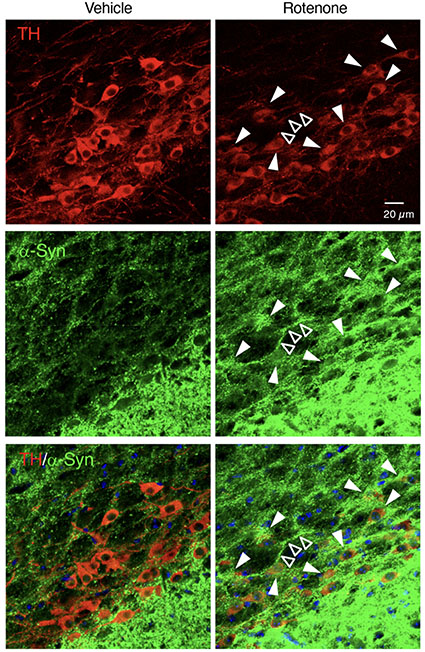
Miyazaki et al., Int. J. Mol. Sci., 21(9): 3254, 2020.

Miyazaki et al., Int. J. Mol. Sci., 21(9): 3254, 2020.
ロテノン投与パーキンソン病モデルマウスにコーヒー酸,クロロゲン酸を経口投与するとグリア細胞でのメタロチオネイン発現が誘導され,黒質ドパミン神経および腸管筋間神経叢の変性脱落が抑制されました.
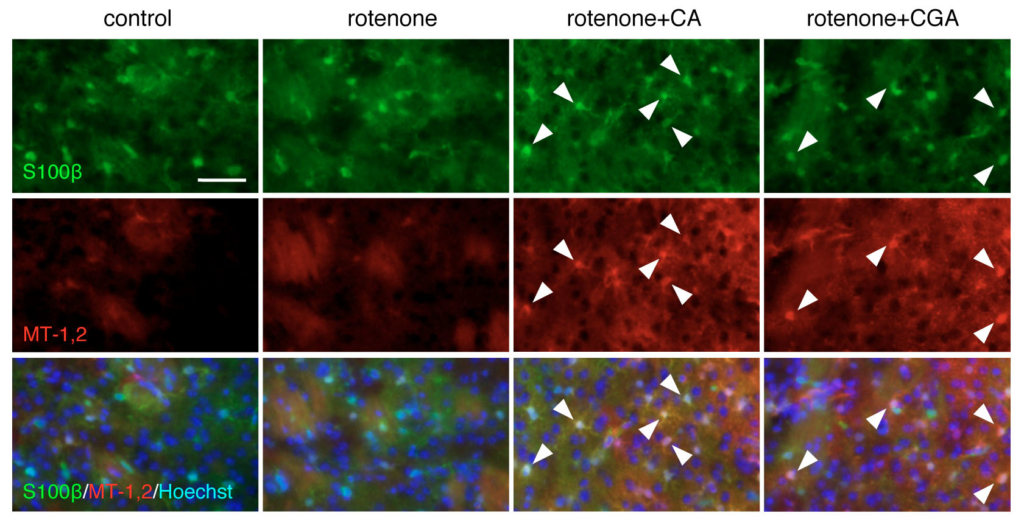
アストロサイトにおけるメタロチオネイン発現誘導
Miyazaki et al., Cells, 8(3): pii: E221, 2019.
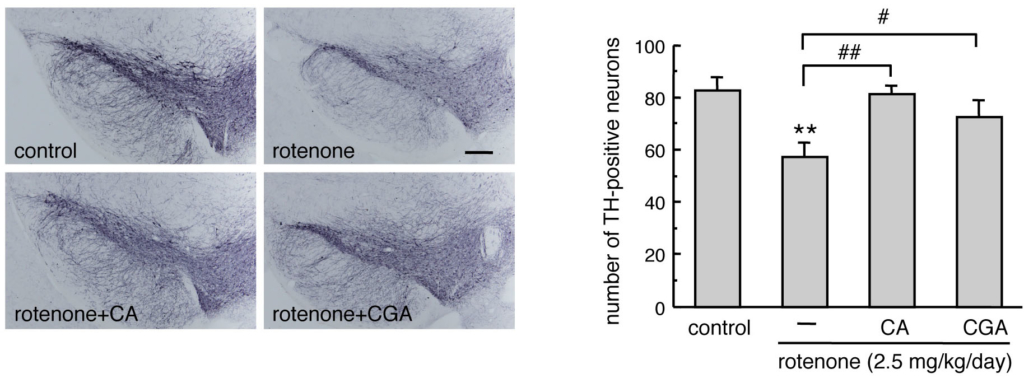
黒質ドパミン神経保護作用
Miyazaki et al., Cells, 8(3): pii: E221, 2019.
カフェイン酸 (CA),クロロゲン酸 (CGA)投与による抑制
Miyazaki et al., Cells, 8(3): pii: E221, 2019.
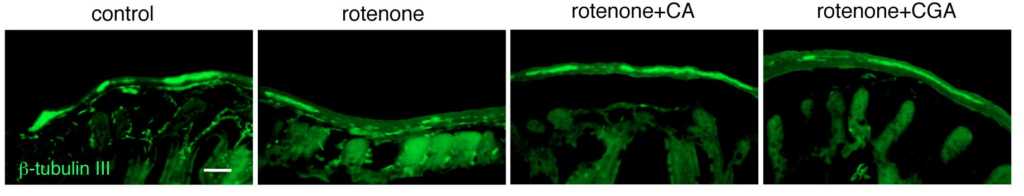
腸管神経障害およびアストロサイト様グリア細胞の関与について
研究しています.
メタロチオネインノックアウトマウスにロテノンを慢性皮下投与すると野生型マウスと比べ,腸管筋間神経叢の脱落が増悪しました.末梢腸管神経系においてもグリア細胞が発現するメタロチオネインが神経保護に働いていることを報告しました.
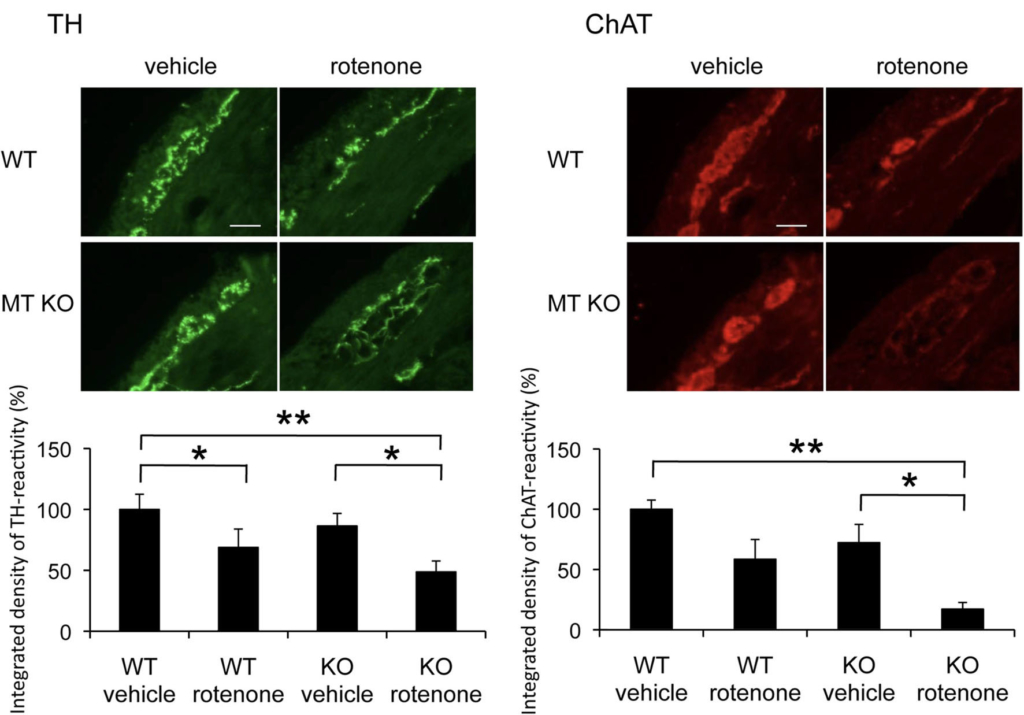
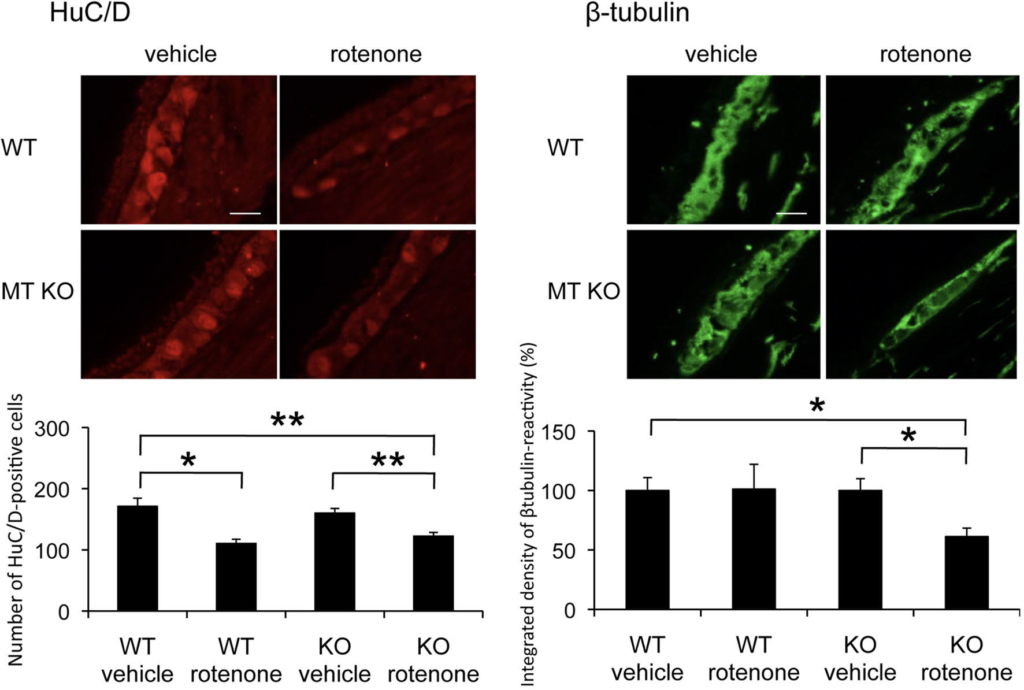
参考文論文 1. Miyazaki, I. and Asanuma, M.: The rotenone models reproducing central and peripheral features of Parkinson's disease. NeuroSci., 1(1): 1-14, 2020. doi: 10.3390/neurosci1010001 2. Miyazaki, I., Isooka, N., Imafuku, F., Sun, J., Kikuoka, R., Furukawa, C. and Asanuma, M.: Chronic systemic exposure to low-dose rotenone induced central and peripheral neuropathology and motor deficits in mice: Reproducible animal model of Parkinson's disease. Int. J. Mol. Sci., 21(9): 3254, 2020. doi: 10.3390/ijms21093254 3. Miyazaki, I., Isooka, N., Wada, K., Kikuoka, R., Kitamura, Y., and Asanuma, M.: Effects of enteric environmental modification by coffee components on neurodegeneration in rotenone-treated mice. Cells, 8(3): pii: E221, 2019. doi:10.3390/cells8030221. 4. Murakami, S., Miyazaki, I., Miyoshi, K. and Asanuma, M.: Long-term systemic exposure to rotenone induces central and peripheral pathology of Parkinson's disease in mice. Neurochem. Res., 40(6): 1165-1178, 2015. doi: 10.1007/s11064-015-1577-2. 5. Murakami, S., Miyazaki, I., Sogawa, N., Miyoshi, K. and Asanuma, M.: Neuroprotective effects of metallothionein against rotenone-induced myenteric neurodegeneration in parkinsonian mice. Neurotox. Res., 26(3): 285-98, 2014. doi: 10.1007/s12640-014-9480-1